
Svi iLive sadržaji medicinski se pregledavaju ili provjeravaju kako bi se osigurala što je moguće točnija činjenica.
Imamo stroge smjernice za pronalaženje izvora i samo povezujemo s uglednim medijskim stranicama, akademskim istraživačkim institucijama i, kad god je to moguće, medicinski pregledanim studijama. Imajte na umu da su brojevi u zagradama ([1], [2], itd.) Poveznice koje se mogu kliknuti na ove studije.
Ako smatrate da je bilo koji od naših sadržaja netočan, zastario ili na neki drugi način upitan, odaberite ga i pritisnite Ctrl + Enter.
Zašto preživljavanje fotoreceptorskih stanica ne doseže 100%: Razjašnjeni ključni mehanizmi
Posljednji pregledao: 09.08.2025
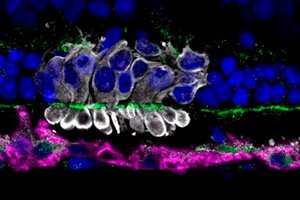
Znanstvenici sa Sveučilišta u Pennsylvaniji, predvođeni Raghavijem Sudharsanom, otkrili su zašto oko 70% transplantiranih fotosenzornih progenitorskih stanica (PRPC) iz induciranih pluripotentnih matičnih stanica umire unutar prvih nekoliko dana nakon transplantacije u mrežnicu. Njihov rad, objavljen u časopisu Stem Cell Research & Therapy, ukazuje na metabolički stres u donorskim stanicama kao glavnog krivca za rani gubitak.
Preduvjeti
Transplantacija PRPC-ova smatra se obećavajućim pristupom za progresivne degenerativne bolesti mrežnice (retinitis pigmentosa, makularna degeneracija). Međutim, niska stopa preživljavanja donorskih stanica ograničava učinkovitost terapije. Do sada je glavni fokus bio na suzbijanju imunološkog odgovora, ali čak i uz opsežnu imunosupresiju, gubici su ostali katastrofalni.
Dizajn i metode
Modeli:
Zdravi psi i psi s modelom retinitis pigmentose primili su subretinalne injekcije fluorescentno obilježenih PRPC-ova.
Procjena preživljavanja:
Fluoresceinskom angiografijom i optičkom koherentnom tomografijom (OCT) zabilježen je volumen transplantiranih stanica prvog, trećeg i sedmog dana.
Transkriptomika pojedinačnih stanica (scRNA-seq):
PRPC-ovi su izolirani iz mjesta mrežnice trećeg dana i analizirana je ekspresija gena povezanih s metabolizmom i apoptozom.
Imunohistokemija:
U području transplantacije procijenjeni su markeri oksidativnog stresa (4-HNE), mitohondrijski status (Tom20) i aktivacija mikroglije (Iba1).
Ključni rezultati
- Masivni gubitak stanica: približno 70% PRPC-ova nestalo je do 7. dana i u zdravim i u degenerirajućim mrežnicama unatoč imunosupresiji.
- Metabolički stres: scRNA-seq otkrio je dramatično smanjenje ekspresije gena oksidativne fosforilacije (CYCS, COX4I1) i povećanje transkripcije apoptotičkih markera (BAX, CASP3).
- Mitohondrijska disfunkcija: Imunohistokemija je pokazala fragmentaciju i gubitak Tom20 označavanja u transplantiranim PRPC-ima, a povišene razine 4-HNE ukazivale su na oksidativno oštećenje.
- Uloga mikroglije: U području transplantacije, aktivnost mikroglijalnih stanica Iba1⁺ povećala se kao odgovor na smrt PRPC-a, što bi moglo pogoršati lokalnu upalu i doprinijeti daljnjim gubicima.
Implikacije za stanične terapije
Ovi nalazi mijenjaju paradigmu: za povećanje prihvaćanja PRPC-a potrebno je ne samo suzbiti imunološki odgovor, već i podržati energetski metabolizam donorskih stanica. Moguće intervencije:
- Preliminarni "metabolički predtrening" PRPC-ova u normalnim uvjetima kulture na rubu substresnog opterećenja kako bi se poboljšala njihova mitohondrijska otpornost.
- Kokteli mitohondrijskih stabilizatora (koenzim Q₁₀, karnitin) tijekom i neposredno nakon transplantacije.
- Modulacija lokalnog mikrookruženja mrežnice: dostava antioksidansa ili mitohondrijskih zaštitnika u područje transplantacije.
Praktični zaključci i perspektive
- Metaboličko prekondicioniranje: kondicioniranje PRPC-a u uvjetima blagog metaboličkog stresa prije transplantacije kako bi se povećala njihova otpornost.
- Dostava skele: korištenje biorazgradivih matrica koje osiguravaju postupni prijelaz donorskih stanica iz bogatog medija za kulturu u retinalnu okolinu.
- Nutritivna podrška: isporuka antioksidansa ili supstrata mitohondrijskog disanja u kombinaciji s PRPC-ima.
„Dugo se borimo samo protiv imunološke barijere, ali sada je jasno da su bez rješavanja problema metaboličkog šoka transplantacije osuđene na ranu smrt“, zaključuje Raghavi Sudharsan.
Rad, koji podržava Nacionalni institut za oči, otvara put održivijim staničnim terapijama za vraćanje vida pacijentima s degenerativnim bolestima mrežnice.
