
Svi iLive sadržaji medicinski se pregledavaju ili provjeravaju kako bi se osigurala što je moguće točnija činjenica.
Imamo stroge smjernice za pronalaženje izvora i samo povezujemo s uglednim medijskim stranicama, akademskim istraživačkim institucijama i, kad god je to moguće, medicinski pregledanim studijama. Imajte na umu da su brojevi u zagradama ([1], [2], itd.) Poveznice koje se mogu kliknuti na ove studije.
Ako smatrate da je bilo koji od naših sadržaja netočan, zastario ili na neki drugi način upitan, odaberite ga i pritisnite Ctrl + Enter.
Novi pristup blokira adaptaciju stanica raka i udvostručuje učinkovitost kemoterapije
Posljednji pregledao: 27.07.2025
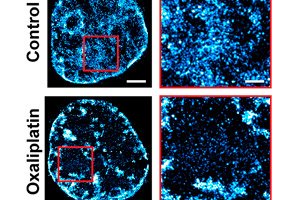
U potpuno novom pristupu liječenju raka, biomedicinski inženjeri sa Sveučilišta Northwestern udvostručili su učinkovitost kemoterapije u eksperimentu na životinjama.
Umjesto izravnog napada na rak, ova jedinstvena strategija sprječava stanice raka da evoluiraju i postanu otporne na liječenje - čineći bolest osjetljivijom na postojeće lijekove. Ovaj pristup ne samo da je praktički iskorijenio bolest u staničnim kulturama, već je i značajno poboljšao učinkovitost kemoterapije u mišjim modelima raka jajnika.
Studija je objavljena u časopisu Proceedings of the National Academy of Sciences.
„Stanice raka su izvrsni adaptori“, kaže Vadim Backman sa Sveučilišta Northwestern, koji je vodio studiju. „Mogu se prilagoditi gotovo svemu. Prvo nauče kako izbjeći imunološki sustav. Zatim nauče kako se oduprijeti kemoterapiji, imunoterapiji i zračenju. Kada postanu otporne na ove tretmane, žive dulje i stječu nove mutacije. Nismo htjeli izravno ubiti stanice raka. Htjeli smo im oduzeti supermoć - njihovu urođenu sposobnost prilagodbe, promjene i izbjegavanja.“
Backman je profesor biomedicinskog inženjerstva i medicine na Sveučilištu Northwestern, gdje vodi Centar za fizikalnu genomiku i inženjerstvo. Također je član Sveobuhvatnog centra za rak Robert H. Leury, Instituta za kemiju životnih procesa i Međunarodnog instituta za nanosnanost.
Kromatin je ključ preživljavanja raka
Rak ima mnogo karakterističnih obilježja, ali jedna osobina je temelj svih njih: njegova neumoljiva sposobnost preživljavanja. Čak i kada imunološki sustav i agresivni medicinski tretmani napadnu tumor, rak se može smanjiti ili usporiti rast, ali rijetko potpuno nestane. Iako genetske mutacije doprinose otpornosti, mutacije se događaju presporo da bi objasnile brzi odgovor stanica raka na stres.
U nizu studija, Backmanov tim otkrio je temeljni mehanizam koji objašnjava tu sposobnost. Složena organizacija genetskog materijala zvanog kromatin određuje sposobnost raka da se prilagodi i preživi čak i najmoćnije lijekove.
Kromatin, skupina makromolekula koja uključuje DNK, RNK i proteine, određuje koji su geni potisnuti, a koji eksprimirani. Kako bi se dva metra DNK koja čini genom spakirala u prostor od samo stotinke milimetra unutar stanične jezgre, kromatin je izuzetno zbijen.
Kombiniranjem snimanja, modeliranja, analize sustava i in vivo eksperimenata, Backmanov tim je otkrio da 3D arhitektura ovog paketa ne samo da kontrolira koji se geni aktiviraju i kako stanice reagiraju na stres, već i omogućuje stanicama da fizički kodiraju "memoriju" obrazaca transkripcije gena u geometriju samog paketa.
Trodimenzionalni raspored genoma djeluje kao sustav samoučenja, sličan algoritmu strojnog učenja. Dok „uči“, ovaj raspored se neprestano reorganizira u tisuće nanoskopskih domena za pakiranje kromatina. Svaka domena pohranjuje dio transkripcijske memorije stanice, koji određuje kako stanica funkcionira.
Reprogramiranje kromatina za poboljšanje kemoterapije
U novoj studiji, Backman i njegovi kolege razvili su računalni model koji koristi fizikalne principe za analizu kako pakiranje kromatina utječe na vjerojatnost preživljavanja kemoterapije stanica raka. Primjenom modela na različite vrste stanica raka i klase kemoterapijskih lijekova, tim je otkrio da može točno predvidjeti preživljavanje stanica - čak i prije početka liječenja.
Budući da je pakiranje kromatina ključno za preživljavanje stanica raka, znanstvenici su se zapitali: što bi se dogodilo ako bi se arhitektura pakiranja promijenila? Umjesto stvaranja novih lijekova, pregledali su stotine postojećih lijekova kako bi pronašli kandidate koji bi mogli modificirati fizičko okruženje unutar staničnih jezgri i utjecati na pakiranje kromatina.
Tim je na kraju odabrao celekoksib, protuupalni lijek odobren od strane FDA-e koji se već koristi za liječenje artritisa i kardiovaskularnih bolesti, a koji, kao nuspojava, mijenja pakiranje kromatina.
Eksperimentalni rezultati
Kombiniranjem celekoksiba sa standardnom kemoterapijom, istraživači su primijetili značajan porast broja uginulih stanica raka.
U mišjim modelima raka jajnika, kombinacija paklitaksela (uobičajenog kemoterapijskog lijeka) i celekoksiba smanjila je brzinu prilagodbe stanica raka i poboljšala supresiju rasta tumora, nadmašujući učinak samog paklitaksela.
„Kada smo koristili nisku dozu kemoterapije, tumori su nastavili rasti. Ali kada smo kemoterapiji dodali kandidata za TPR (regulator transkripcijske plastičnosti), vidjeli smo puno značajniju inhibiciju rasta. Udvostručila je učinkovitost“, rekao je Backman.
Mogući izgledi
Ova strategija bi mogla omogućiti liječnicima korištenje nižih doza kemoterapije, smanjujući teške nuspojave. To bi značajno poboljšalo udobnost pacijenata i njihovo iskustvo liječenja raka.
Backman vjeruje da bi reprogramiranje kromatina moglo biti ključno za liječenje drugih složenih bolesti, uključujući kardiovaskularne i neurodegenerativne bolesti.
