
Svi iLive sadržaji medicinski se pregledavaju ili provjeravaju kako bi se osigurala što je moguće točnija činjenica.
Imamo stroge smjernice za pronalaženje izvora i samo povezujemo s uglednim medijskim stranicama, akademskim istraživačkim institucijama i, kad god je to moguće, medicinski pregledanim studijama. Imajte na umu da su brojevi u zagradama ([1], [2], itd.) Poveznice koje se mogu kliknuti na ove studije.
Ako smatrate da je bilo koji od naših sadržaja netočan, zastario ili na neki drugi način upitan, odaberite ga i pritisnite Ctrl + Enter.
Lijek LM11A-31 usporava napredovanje Alzheimerove bolesti u ispitivanju
Posljednji pregledao: 02.07.2025
 ">
">U nedavnoj studiji objavljenoj u časopisu Nature Medicine, znanstvenici su proveli randomiziranu, dvostruko slijepu, placebom kontroliranu studiju faze 2a kako bi ispitali sigurnost i učinkovitost LM11A-31 u liječenju Alzheimerove bolesti (AB) modulacijom neurotrofinskog receptora p75 (p75NTR).
Alzheimerova bolest s kasnim početkom najčešći je oblik demencije, karakteriziran sinaptičkim zatajenjem, degeneracijom i gubitkom živčanih stanica. Iako dva vodeća lijeka za liječenje Alzheimerove bolesti ciljaju na nakupljanje abnormalnih amiloid-β ili tau proteina, oni se bave samo dijelom patofiziologije. Drugi pristup uključuje ciljanje receptora i signalnih mreža koje utječu na temeljne biološke putove. Prekliničke studije pokazuju da modulacija p75NTR novom malom kemijskom molekulom, LM11A-31, smanjuje sinaptički gubitak uzrokovan amiloidom i abnormalnim tau proteinom.
Opis studije
U ovom randomiziranom kliničkom ispitivanju, istraživači su ispitali može li LM11A-31 usporiti napredovanje Alzheimerove bolesti moduliranjem p75NTR kod ljudi.
Sudionicima studije davane su oralne kapsule LM11A-31 u dozama od 200 mg i 400 mg ili placebo u omjeru 1:1:1 na 242 pacijenta s blagom do umjerenom astmom tijekom 26 tjedana. Sudionici su imali biološki potvrđenu Alzheimerovu bolest (razina β proteina 42 (Aβ42) u cerebrospinalnoj tekućini ispod 550 ng/L ili omjer Aβ42:β40 ispod 0,89) dijagnosticiranu prema McKhannovim kriterijima, s rezultatima Mini-psihijatrijskog pregleda (MMSE) od 18 do 26, rezultatima na Gerijatrijskoj skali depresije (GDS) ispod 5,0, rezultatima na modificiranoj Hachinskijevoj skali ishemijske bolesti (HIS) ≤ 4,0, formalnim obrazovanjem ≥ 8 godina i prethodnim kognitivnim padom ≥ 6 mjeseci.
Prihvatljivi sudionici uzimali su inhibitore acetilkolinesteraze (AChEI) ili parcijalne antagoniste NMDA receptora ≥ 3 mjeseca prije uključivanja u studiju. Nisu uzimali ilegalne droge poput antipsihotika, benzodiazepina, antiepileptika, sedativa, centralno aktivnih antihipertenziva, nootropika (osim ginka bilobe) ili analgetika koji sadrže opioide.
Primarni ishod studije bila je sigurnost i podnošljivost, procijenjene pomoću ljestvice za ocjenjivanje ozbiljnosti suicidalnih misli i ponašanja Columbia (C-SSRS), vitalni znakovi, krvni tlak i hematološki parametri. Za procjenu sekundarnih kognitivnih ishoda korišteni su strukturna magnetska rezonancija (cMRI), fluorodeoksiglukozna pozitronska emisijska tomografija (FDG-PET) i biomarkeri cerebrospinalne tekućine (CSF). Mjere AD uključivale su Thr181-fosforilirani tau, ukupni tau protein, Aβ40, Aβ42 i aktivnost AChE. Tim je koristio prilagođeni neuropsihološki test za procjenu sekundarnih kognitivnih ishoda na početku, u 12. i 26. tjednu.
Rezultati istraživanja
Studija je pokazala da je LM11A-31 siguran i dobro podnošljiv, bez značajnih sigurnosnih problema. Najčešći štetni događaji uključivali su glavobolju, proljev, eozinofiliju i nazofaringitis, a gastrointestinalni problemi i eozinofilija bili su glavni razlozi za prekid uzimanja lijeka. U skupini koja je primala 400 mg bilo je više prekida uzimanja lijeka u usporedbi sa skupinama koje su primale 200 mg i placebo. Magnetska rezonancija nije otkrila sigurnosne probleme, uključujući abnormalnosti povezane s amiloidom. Nije bilo značajnih razlika u kognitivnim rezultatima ili abnormalnostima amiloida između dvije skupine liječenja.
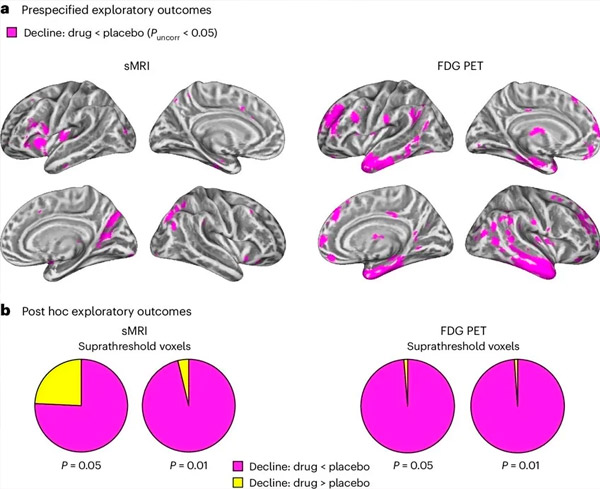
A. Dvosmjerna mješovita analiza modela kovarijance ispitala je interakcije između liječenja (lijek ili placebo) i vremena (prije ili poslije liječenja). Jednostrani t-kontrast kojim se ispituje hipoteza o interakciji (lijek usporava progresiju u usporedbi s placebom) pokazao je da je liječenje LM11A-31 usporilo longitudinalnu degeneraciju (lijevi paneli) i hipometabolizam glukoze (desni paneli) u skupini koja je primala lijek (cMRI, n = 127; PET, n = 121) u usporedbi s placebo skupinom (cMRI, n = 66; PET, n = 62). Voksel koji pokazuje ovu interakciju prikazani su na nekorigiranom pragu od P < 0,05 (magenta) na populacijski specifičnoj kortikalnoj površini. Lijeva i desna hemisfera prikazane su u gornjem i donjem redu. Regije mozga koje pokazuju interakcije koje nisu u skladu s hipotezom prikazane su na slici 7 u Dodatnim podacima.
B. Ukupan broj voksela u unaprijed definiranim ranjivim regijama mozga za Alzheimerovu bolest (ukupna površina tortnih dijagrama) koji pokazuju ili interakciju u skladu s hipotezom (magenta) ili interakciju koja nije u skladu s hipotezom (žuta) u svakoj modaliteti snimanja (cMRI, lijevi panel; FDG PET, desni panel) pri sve liberalnijim pragovima nekorigiranog P < 0,01 i P < 0,05. Monte Carlo simulacije pokazale su da su omjeri voksela koji pokazuju učinke u skladu s hipotezom naspram onih koji nisu u skladu s hipotezom bili značajno veći od onih uočenih na temelju nasumično generiranih podataka za cMRI i PET (P < 0,001 za svaki modalitet; dvostrani test).
LM11A-31 je učinkovito smanjio porast Aβ42 i Aβ40 u cerebrospinalnoj tekućini u usporedbi s placebo skupinom. Lijek je također pokazao smanjenje srednje godišnje postotne promjene presinaptičkog proteinskog biomarkera SNAP25 i smanjenje postsinaptičkog biomarkera NG, što ukazuje na usporavanje gubitka presinaptičkih i postsinaptičkih veza. LM11A-31 je također smanjio porast YKL40, što je dovelo do smanjenja MMSE rezultata i povećanja ADAS-Cog-13 rezultata. Lijek je također smanjio gubitak sive tvari u frontalnom režnju i stražnjem parijetalnom korteksu te smanjenje metabolizma glukoze u područjima kao što su entorhinalni korteks, temporalni korteks, hipokampus, inzularni korteks i prefrontalni korteks.
Zaključak
Studija je zaključila da je modulacija p75NTR pomoću LM11A-31 prikladna za veća klinička ispitivanja. LM11A-31 je ispunio primarnu sigurnosnu završnu točku i dobro je podnošen kod pacijenata s blagim do teškim Alzheimerovim oboljenjem. Rezultati ukazuju na potrebu za daljnjim studijama s duljim trajanjem liječenja kako bi se procijenio potencijal malih molekula za regulaciju p75NTR kao terapije koja modificira tijek bolesti kod Alzheimerove bolesti. Studija je pokazala da LM11A-31 značajno utječe na nekoliko biomarkera, uključujući Aβ40, Aβ42, SNAP25, NG i YKL40, što ukazuje na usporavanje patološke progresije. Buća istraživanja mogu procijeniti dodatne pokazatelje glijalnog zdravlja.
